Enlace: es la fuerza que permite mantene unido a los atomos poporcionandole al atomo o molecula estabilidad
tipos de enlace:
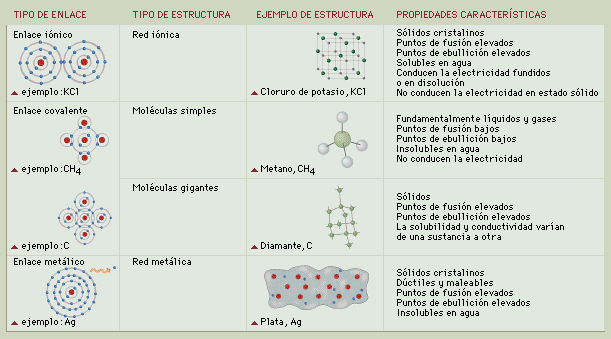
e. convalente: los atomos comparten electrones; lo puede ser polar o no polar, polar : cuando la electronegatividad da menor o igual 0.5 y no polares es inferior a 0.5
e. ionico:se arranca un electron.su electronegatividades mayor o igual a 1.7
e.dativo o covalente coordinado: los electrones son aportados por uno de los atomos
Estructua del atomo: al atomo esta formado por dos parte, la corteza formada por electrones (cargas negativas) y el nucleo por protones(cargados positivamente ) y neurtones(cargado negativamente)
Enlace de valencia: es la naturaleza del enlace quimico pero a patir de las valencias del atomo
Hibridacion: ocurre cuando en un átomo se mezclan los electrones de la ultima capa con los del orbital anterior
Geometria Molecular: es el ordenamiento espacial y tridimencional de los atomos
Configuracion Electronica: es la distribucion de los electrones de acuerdo asus numeros de orbitles o niveles de enregia
FUERZAS INTERMOLECULARES:
Fuerza Dipolo-Dipolo: atracción entre moléculas polares
Fuerzas Ion-Dipolo: cuando a una molécula polar se le acerca una partícula cargada bien sea positiva o negativamente, esta tiende a dispersas las cargas de la molécula polar
Puentes de Hidrogeno: interacción que se da entre una molécula de n, o, f
Fuerzas de London: fuerzas que se dan entre moleculas apolares produciendo un momento dipolar temporal que se llaman dipolos inducidos.
Fuerzas de Van Der Walls: juegan un papel importante en las propiedades físicas de las sustancias
propiedades periodicas
- Potencial de ionización: energía necesaria para atrapar un electrón.
- Electronegatividad: fuerza para atraer electrones.
- Afinidad electrónica: energía liberada al captar un electrón.
REVISTA, HISTORIA DEL ATOMO
El átomo: una historia sin final ,Ramón Sanchís, Revista Esfinge, Esfinge núm 42 - Enero 2004,http://www.editorial-na.com/articulos/articulo.asp?artic=197
¿SIN AYUDA DE LOS DESCUBRIMIENTOS DE LOS RAYOS CATODICOS, RAYOS X, Y TODOS AQUELLOS QUE PERMITIERON ENTENDER LAS PARTICULAS Y SU ESTRUCTURA, HUBIERA SIDO POSIBLE LLEGAR AL DESCUBRIMIETO DEL ATOMO POR OTRO CAMINO?
QUIMICA GENERAL, DREWH H.WOLFE, SEGUNDA EDICON EN ESPAÑOL, EDITORIAL MCGRAEHILL 1996
http://www.unalmed.edu.co/~cgpaucar/ENLACES.html
http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/atomo/estructura.htm
http://iiquimica.blogspot.com/2006/03/configuracin-electrnica.html
http://es.wikipedia.org/wiki/Teor%C3%ADa_del_enlace_de_valencia
http://iiquimica.blogspot.com/2006/04/geometra-molecular.html
http://iiquimica.blogspot.com/2006/04/geometra-molecular.html
http://www.ehu.es/biomoleculas/moleculas/fuerzas.htm
http://teleformacion.edu.aytolacoruna.es/EQUIMICA/document/propper/propper.htm
http://www.unalmed.edu.co/~cgpaucar/intramoleculares.PDF
http://www.editorial-na.com/articulos/articulo.asp?artic=197





No hay comentarios:
Publicar un comentario