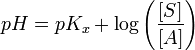Una enzima es un catalizador biológico y, como todos los catalizadores, las enzimas aumentan la rapidez de una reacción química sin sufrir un cambio químico permanente en sí mismas. Un catalizador influye en la rapidez de una reacción química pero no afecta el equilibrio de ésta.
Las enzimas, sin embargo, exhiben muchas propiedades que difieren de los mostrados por los catalizadores en general. Las tres propiedades más importantes son:
1) Su alto poder catalítico
2) Su especificidad
3) La capacidad de regular su actividad catalítica mediante diversos compuestos de origen natura
NOMENCLATURA DE LAS ENZIMAS
Antiguamente los enzimas recibían nombres particulares, asignados por su descubridor (Ptialina salival, pepsina gástrica, tripsina pancreática, etc.), de acuerdo a su acuerdo a su fuente o sitio de procedencia anatómica.
A medida que aumentaba el número de enzimas descubiertas, se empezó a utilizar una nomenclatura más organizada.
Así por ejemplo, el nombre de UREASA fue aplicada a la enzima que cataliza la hidrólisis de la UREA a CO2 y NH3; SACARASA a la enzima que cataliza la hirólisis de la SACAROSA, LIPASA, a la enzima que participa en la hidrólisis de los lípidos; ARGINASA la enzima que hidroliza la ARGININA a ornitina y úrea, AMILASA la enzima que hidroliza el almidón, etc.
Cuando la acción típica de la enzima es la hidrólisis del sustrato, el segundo componente del nombre se omite; así por ejemplo, "lactosa hidrolasa" se llama simplemente lactasa.
Otras enzimas conocidas desde mucho tiempo tienen nombres que no están relacionados con el sustrato ni con la reacción química que catalizan; pero que en la actualidad siguen manteniendo sus nombres: TRIPSINA, PEPSINA, QUIMOTRIPSINA, RENINA.
Junto a los nombres sistemáticos, coexisten otros consagrados por el uso. Así, una glucosa: ATP fosforiltransferasa se conoce habitualmente como glucoquinasa.
Al ir aumentando el número de enzimas conocidos se sintió la necesidad de recurrir a una nomenclatura sistemática que informara sobre la acción específica de cada enzima y los sustratos sobre los que actuaba. En la actualidad, el nombre de un enzima consta de tres partes.
+ +
Ejemplo:
Glucosa 6 fosfato – isomer – asa
La glucosa fosfato isomerasa cataliza la conversión (isomerización) de la glucosa – 6 – fosfato en fructosa – 6 – fosfato. Muchos enzimas – este es un ejemplo – catalizan reacciones reversibles. No hay una regla única para fijar cual de los dos sentidos se utiliza para dar nombre a la enzima. Este podría también llamarse fructosa – 6 – fosfato isomerasa.
Con el fin de uniformizar criterios, la Comisión de Enzimas de la Union Internacional de Bioquímica, publicó en 1961 el Sistema de Nomenclatura; dicho documento recomienda el uso del sustrato sobre el que actúa y al tipo de reacción que catalizan.
Considera dos partes:
1. El número de código
Está formado por cuatro dígitos separados entre sí por puntos
a. PRIMER DIGITO : Indica la clase a la que pertenece la enzima
b. SEGUNDO DIGITO : Indica el grupo químico sobre el que actúa la enzima
c. TERCER DIGITO : Indica el subgrupo químico sobre el que actúa la enzima o señala la necesidad de un determinado cofactor
d. CUARTO DIGITO : Indica el número de orden de la enzima dentro de la clase principal
El nombre de la enzima debe constar de dos partes
a. La primera es el nombre del o de los sustratos con la mención del cofactor necesario
b. La segunda, debe indicar el tipo de reacción catalizada terminado en ASA
Ejemplos
E.C. 1.1.1.1
Nombre común : Alcohol deshidrogenasa
Nombre Sistemático : Alcohol NAD oxidorreductasa
E.C. : Comisión de Enzimas
1. Clase de las oxidorreductasas
1.1. Actúan sobre el grupo – CH2 - OH
1.1.1. Tiene como coenzima al NAD
1.1.1.1 Número de orden de la enzima dentro de las oxidorreductasas
En el ejemplo, el alcohol es el sustrato, NAD el cofactor requerido por esta enzima y el sufijo ASA va después de la designación del tipo de reacción, oxidorreductasa
Los nombres sistemáticos son usados cuando es necesario una identificación exacta de la enzima, pero tiene el inconveniente de ser largos; mientras que los nombres comunes son cortos y de uso práctico, ya que hacen referencia a alguna característica general; especialmente de aquellos que catalizan las reacciones bioquímicas más importantes. Por lo tanto las enzimas tienen.
a. Un número que lo identifica
b. Un nombre sistemático
c. Un nombre común
CLASIFICACION DE LAS ENZIMAS
La clasificación de los enzimas se lleva acabo atendiendo a su acción catalítica específica.
2. Transferasas
3. Hidrolasas
4. Liasas o sintasas
5. Isomerasas
6. Ligasas o sintetasas.
Clase 1.
Reacción Genérica:
AH2 + B ⇔ A + BH2
AReducido + BOxidado ⇔ AOxidado + BReducido
Oxidorreductasas. Catalizan reacciones de óxidorreducción, es decir, transferencia de hidrógeno o electrones de un sustrato a otro. Clase 2.
Reacción Genérica:
A – B + C ⇔ A + C – B
Transferasas. Catalizan la transferencia de un grupo químico (distinto del hidrógeno) de un sustrato a otro. Clase 3.
Reacción Genérica:
A – B + H2O ⇔ A – H + B – OH
Hidrolasas. Catalizan reacciones de hidrólisis. Clase 4.
Reacción Genérica:
A – B ⇔ A + B
Liasas. Catalizan reacciones de ruptura o soldadura de sustratos. Clase 5.
Reacción Genérica:
A ⇔ B
Isomerasas. Catalizan la interconversión de isómeros. Clase 6.
Ligasas. Catalizan la unión de dos sustratos con hidrólisis simultánea de un nucleótido trifosfato (ATP, GTP, etc.). La cinética enzimática
estudia la velocidad de las reacciones químicas que son catalizadas por las enzimas. El estudio de la cinética y de la dinámica química de una enzima permite explicar los detalles de su mecanismo catalítico, su papel en el metabolismo, cómo es controlada su actividad en la célula y cómo puede ser inhibida su actividad por fármacos o venenos o potenciada por otro tipo de moléculas.
Cinética de Michaelis-Menten
La derivación de la ecuación se basa en:
1) que la concentración de S es mayor que la
concentración de E
2) La concentración de Producto al inicio de la
reacción es insignificante
3) el paso limitante de la velocidad es la
transformación de ES a E+P
Factores físico-químicos que pueden modificar la actividad enzimática
- Temperatura: las enzimas son sensibles a la temperatura pudiendo verse modificada su actividad por este factor. Los rangos de temperaturas óptimos pueden llegar a variar sustancialmente de unas enzimas a otras. Normalmente, a medida que aumente la temperatura, una enzima verá incrementada su actividad hasta el momento en que comience la desnaturalización de la misma, que dará lugar a una reducción progresiva de dicha actividad.
- pH: el rango de pH óptimo también es muy variable entre diferentes enzimas. Si el pH del medio se aleja del óptimo de la enzima, esta verá modificada su carga eléctrica al aceptar o donar protones, lo que modificará la estructura de los aminoácidos y por tanto la actividad enzimática.
- Concentración salina: al igual que en los casos anteriormente mencionados, la concentración de sales del medio es crucial para una óptima actividad enzimática. Una elevada concentración o una ausencia de sales en el medio pueden impedir la actividad enzimática, ya que las enzimas precisan de una adecuada concentración de iones para mantener su carga y su estructura.
Es una pequeña molécula orgánica que se une a una enzima y que es esencial para su actividad, pero que no sufre una alteración permanente en la reacción. La mayor parte de las coenzimas derivan de las vitaminas y cada tipo de coenzima tiene una función bioquímica concreta. Algunas son agentes de oxidorreducción, otras facilitan la transferencia de grupos, entre otras actividades bioquímicas. Por lo tanto, las coenzimas son la forma activa de las vitaminas, como por ejemplo, la forma activa o coenzimática de la tiamina es el pirofosfato de tiamina (PPT), siempre y cuando la célula produzca ATP (adenosina trifosfato, molécula energética) y pueda fosforilar a la vitamina para convertirla en coenzima (su forma activa). El PPT es una coenzima transferasa, isomerasa y liasa, que interviene en varias reacciones de transferencia de grupos C2-aldehído y en las descarboxilaciones, como por ejemplo, del ácido pirúvico y del ácido alfa-cetoglutárico.
para mas informacion ve a vitaminas y conoce las utilidades de cada una de ellas
Mecanismo de acción
Una enzima, por sí misma, no puede llevar a cabo una reacción, su función es modificar la velocidad de la reacción, entendiéndose como tal la cantidad de producto formado por unidad de tiempo. Tal variación se debe a la disminución de la energía de activación Ea; en una reacción química, la Ea es la energía necesaria para convertir los reactivos en formas moleculares inestables denominadas especies en estado de transición, que poseen mayor energía libre que los reactivos y los productos.
La enzima realiza esta acción mediante:
- Orientar a los sustratos: Parte de la energía de activación se utiliza para que los sustratos roten y se enfrenten con los átomos correctos para formar los enlaces.
- Agregar cargas a los sustratos: Las cadenas laterales (R) de los aminoácidos de las enzimas pueden participar directamente haciendo a los sustratos químicamente más reactivos.
- Inducir la deformación en el sustrato: Cuando una sustancia se une al sitio activo, la enzima puede causar que los los enlaces se estiren, poniéndolo en un estado de transición inestable.
- Cambiar de forma de la enzima al unirse al sustrato: El modelo de llave- cerradura de Fisher fue actualizado cuando se descubrió que las enzimas son flexibles y sus sitios activos pueden cambiar (expandirse) para acomodarse a sus sustratos. Este cambio de forma causado por la unión al sustrato se denomina ajuste inducido. En la Hexoquinasa puede observarse este ajuste inducido, con el sustrato (glucosa) y sin él. El ajuste inducido alinea las cadenas laterales reactivas del sitio activo de la enzima con los sustratos.
Anonimo,ferato.com http://www.ferato.com/wiki/index.php/Enzima
ANONIMO, O.B center mexico, http://www.ob-center.com/coenzima.htm, ppccenter@aol.com, Última modificación: 8 de Febrero de 2009
YABAR VILLANUEVA emilio fredi, PROFESOR: Ing. M.Sc. UNIVERSIDAD NACIONAL DEL CENTRO DEL PERU http://www.uncp.edu.pe/botonpages/facultades/Industrias/descargas/ENZIMAS.pdf [EN LINEA]