AMORTIGUADORES DE PH
Disolución Amortiguadora, Tampón o Buffer, son mezclas de acidos debiles y sus bases conjugadas.su capacidad de servir de tampon resistiendo al cambio de PH depende de dos factores: la concentracion del tampon y el PH del cual este tampom es usado.
El objeto de su empleo, tanto en técnicas de laboratorio como en la finalidad funcional del plasma, es precisamente impedir o amortiguar las variaciones de pH y, por eso, suele decirse que sirven para mantener
constante el pH. Los mas sencillos están formados por mezclas binarias de un ácido débil y una sal del mismo ácido con base fuerte, por ejemplo, una mezcla de ácido acético y acetato de sodio; o bien una base débil y la sal de esta base con un ácido fuerte, por ejemplo, amoníaco y cloruro de amonio. Un buen ejemplo de esta solucion amortiguadora es la sangre; la adiccion de pequeñas cantidades de acido o base cambian su PH en unas pocas centesimas, mientras que la adiccion de estas mismas cantidades al agua alteran su ph de manera notable.
Cálculo del pH de disoluciones tampón
Frecuentemente se utiliza la ecuación de Henderson-Hasselbalch para el cálculo del pH en soluciones reguladoras. Sin embargo, debe aclararse que esta ecuación no es aplicable en todos los casos, ya que para su deducción se realiza una serie de suposiciones. Esta ecuación suele proporcionar resultados incorrectos cuando las concentraciones del ácido y su base conjugada (o de la base y su ácido conjugado) son bajas.
(ecuacion de henderson halssebalch)
donde: S es la sal o especie básica, A es el ácido o especie ácida.
En la última ecuación x puede ser a o b indistintamente
EJEMPLOS:
Ejercicio 4. Calcular el pH de una mezcla equimolar de NH3 y NH4Cl. El pKb del amoniaco es 4.75,
Para una solución amortiguadora compuesta de una base débil y una sal de su correspondiente ácido conjugado
POH =Pkb + Log concentracion de la sal/ concentracion de la base
Al aplicar esta ecuación al sistema amortiguador amoniaco / cloruro de amonio resulta que el
pOH = pKb = 4.75
y entonces, el pH = 14 - 4.75 = 9.25
IMPORTANCIA BIOLOGICA DE LOS TAMPONES
Tampon en las proteinas:
Los aminoácidos y proteínas son electrolitos anfóteros, es decir, pueden tanto ceder protones (ácidos) como captarlos (bases) y, a un determinado pH (en su pI), tener ambos comportamientos al mismo tiempo. La carga depende del pH del medio. En un medio muy básico se cargan negativamente, mientras que en el fuertemente ácido lo hacen positivamente. Desde el punto de vista fisiológico este tipo de amortiguador es resulta de especial interés a nivel tisular.
Tampón hemoglobina
Es un tampón fisiológico muy eficiente debido tanto al cambio de pK que experimenta al pasar de la forma oxidada a la reducida, como a la gran abundancia de esta proteína en la sangre (15 % del volumen total sanguíneo).
La oxihemoglobina (pK= 7,16) es un ácido más fuerte que la desoxihemoglobina (pK= 7,71). Los valores de pK son tales que determinan que en la disociación siguiente, el valor x sea, aproximadamente, 0,7.
HbH+x + O2 → HbO2 + xH+
Esta propiedad de la hemoglobina, de cambiar su valor de pK, demuestra el efecto tampón, permite el transporte de una determinada cantidad de CO2 liberada en los tejidos. La hemoglobina oxigenada que llega a los tejidos se disocia liberando O2, un proceso que está favorecido por el estado de los tejidos (baja pO2, menor pH y alta pCO2).
0,7H+ + HbO2 ←→ HbH+0,7 + O2
TAMPONES INORGANICOS
Tampón carbónico/bicarbonato
Está constituido por H2CO3 y HCO3-. Aunque su valor de pK (6,1) está algo alejado del pH fisiológico de la sangre (7,4), es un sistema muy eficaz debido a que: 1) La relación HCO3-/ H2CO3 es muy alta (20/1), lo que le proporciona una alta capacidad tampón frente a los ácidos; 2) es un sistema abierto, con lo que el exceso de CO2 puede ser eliminado por ventilación pulmonar de manera rápida; y 3) además, el HCO3- puede ser eliminado por los riñones mediante un sistema de intercambio con solutos.
Tampón fosfato
A pH fisiológico, las especies del fosfato con capacidad de tamponar son H2PO4- y HPO42- ya que su valor de pK es de 6,8. Así pues, para el tampón fosfato:
pH = 6,8 + log HPO42- / H2PO4-
A pH fisiológico de 7,4, la concentración de HPO42- (un 80%) es 4 veces superior a la de H2PO4- (un 20%). Así pues, el tampón fosfato es un sistema muy eficaz para amortiguar ácidos. La concentración de fosfato en la sangre es baja (2 mEq/L) por lo que tiene escasa capacidad de tamponar si lo comparamos con otros tampones (ej el bicarbonato). En cambio, a nivel intracelular, las concentraciones de fosfato son elevadas lo que le convierte en un tampón eficiente. Las grandes cantidades de fosfato dentro de las células corporales y en el hueso hacen que el fosfato sea un depósito grande y eficaz para amortiguar el pH
PARA MAS INFORMACION SOBRE PH Y SUSTANCIAS AMORTIGUADORAS
SINONIMOS: AMORTIGUADOR, TAMPON, BUFFER, DISOLUCIONES REGULADORAS
BIBLIOGRAFIA
TUNEZ FIÑAÑA, Isaac et al, pH y amortiguadores: Tampones fisiológicos(en linea), http://www.uco.es/organiza/departamentos/bioquimica-biol-mol/pdfs/06%20pH%20AMORTIGUADORES.pdfm [citado el 11 de septiembre del 2010]
Anonimo, wikipedia.com, http://es.wikipedia.org/wiki/Tamp%C3%B3n_qu%C3%ADmico, [citado el 11 de septiembre del 2010]
Anonimo, wikispaces.com, http://quimicaisfd95.wikispaces.com/file/view/soluciones-buffer3729.pdf, [citado el 11 de septiembre del 2010]



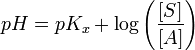


No hay comentarios:
Publicar un comentario